Rappel historique
Les tentatives d’immunothérapie spécifique (ITS) au cours des AA sont déjà anciennes1,2.
• En 1992, Oppenheimer et al. (1) ont utilisé l’ITS par voie sous-cutanée (ITS-SC) chez 4 patients allergiques à l’arachide (3 recevant un extrait aqueux et 1 le placebo) : une réduction de moitié des scores cliniques était presque obtenue lorsqu’un patient sous placebo décéda après l’injection accidentelle d’une dose d’entretien.
En 1997, la même équipe (Denver) publiait les résultats d’une ITS-SC chez 12 patients atteints d’anaphylaxie à l’arachide (6 sous extrait allergénique actif, 6 sous placebo) avec test de provocation oral (TPO) réalisé à l’entrée dans l’étude, puis 6 et 12 mois plus tard (3). La positivité des prick tests (PT), inchangée chez les témoins, diminua chez les patients sous traitement actif, et la tolérance à l’arachide augmenta dans 3 cas, restant partielle dans 2 cas, et inchangée dans 1 cas (3). Toutefois, les réactions systémiques après les injections étaient constantes et sévères : cette expérience, strictement hospitalière et effectuée à proximité d’une unité de réanimation, fut arrêtée car elle comportait beaucoup trop de risques de l’avis même de leurs promoteurs.
• La littérature mentionne également des ITO (induction de tolérance par voie orale) pour le kiwi, la pomme et surtout la noisette.
En 2005, chez 22 sujets ayant une AA à la noisette, Enrique et al. (3) ont effectué une immunothérapie par voie sublinguale (ITS-SL) randomisée en double insu versus placebo. A l’entrée dans l’étude, les patients sous traitement actif réagissaient à 2,29 grammes de noisette au cours du TPO. Au bout de 8 à 12 semaines d’ITO, ils toléraient 11,56 grammes, soit 5 fois plus qu’au début, ce qui les mettait à l’abri d’une ingestion accidentelle de noisette (3). Les résultats à 3 ans furent inchangés (4).
Induction de tolérance aux aliments : que disent les études ?
L’objectif est d’obtenir une accoutumance ou tolérance aux allergènes alimentaires. En effet, l’éviction alimentaire n’est pas toujours une bonne solution pour certains allergènes, surtout le lait de vache ou l’œuf de poule. Si, pour certains sujets, la réactivité à l’aliment s’épuise progressivement, pour d’autres, elle augmente de façon importante avec le temps. De plus, des accidents sévères ou mortels ont été décrits après une éviction alimentaire prolongée prescrite pour des symptômes mineurs (6).
Il est classique de distinguer :
• l’accoutumance (diminution de la réactivité à un allergène nécessitant une consommation régulière de maintenance) ;
• et la tolérance (guérison vraie pouvant persister après l’arrêt de la phase de maintenance).
En fait, cette distinction est très théorique et il existe de nombreuses situations intermédiaires.
- Allergie à l’arachide

Depuis 5 ans, les études portant sur l’ITO se sont multipliées3. En 2011, l’analyse de 5 études montre que l’ITO à l’arachide est possible à condition d’être effectuée de façon très progressive et sur une longue période (7). Toutefois, plusieurs équipes considèrent que la prise de risque n’est pas toujours acceptable.
• Hofmann et al. (8) ont soumis 28 patients (1-16 ans) à une ITO à l’arachide, à l’exclusion du choc anaphylactique et de l’asthme sévère ou non contrôlé. Le protocole comportait 3 périodes :
1. phase d’induction (rush) pendant le 1er jour, en milieu hospitalier (doublement des doses à partir de 0,1 mg, toutes les 30 minutes, jusqu’à la dose cumulée de 99 mg) ;
2. phase d’escalade des doses dans l’unité d’allergologie (ingestion d’une dose journalière qui est augmentée de 25 mg toutes les 2 semaines jusqu’à atteindre 300 mg/jour) ;
3. phase de d’entretien (ou de maintenance) où la dose (en moyenne une cacahuète) est ingérée quotidiennement à domicile pendant 4 à 24 mois.
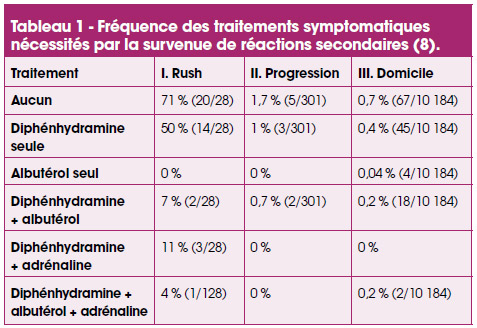
Le tableau 1 montre la fréquence des traitements nécessités par les réactions secondaires au cours des 3 phases de l’ITO. Les réactions nécessitant un traitement symptomatique furent peu fréquentes pendant la phase de maintenance (8) car le risque de réaction à domicile était de 3,5 % (dont 1,2 % de symptômes respiratoires et 1,1 % de symptômes cutanés). Une injection d’adrénaline fut nécessaire à 2 reprises. Au bout de 6-12 mois, les mêmes auteurs (9) ont constaté une diminution des IgE spécifiques (IgEs) de l’arachide, une augmentation des IgG4 spécifiques (IgG4s) et la production de cytokines induites par l’ITO (en particulier IL-1β, IL-5, TNF-α). Globalement, ils considèrent que l’ITO protège les patients des risques d’ingestion d’arachide accidentelle ou masquée.
• Blumchen et al. (10) ont effectué une ITO chez 23 enfants (3,2 à 14,3 ans) atteints d’anaphylaxie IgE-dépendante4.
A l’issue de la phase d’induction, la dose médiane tolérée n’était que de 1,15 g. Au bout de 7 mois, 14 patients (60 %) ont atteint une dose protectrice, la dose réactogène passant de 0,19 gramme (0,02-1 g) à 1 g (0,25-4 grammes). Les effets secondaires furent un retrait du protocole (4/22), des réactions légères à modérées (2,6 % sur 6 137 doses journalières), un bronchospasme (1,3 %) (10).
• Clark et al. (11) ont obtenu une induction de tolérance orale chez 4 patients dont l’un était atteint d’anaphylaxie. La dose réactogène, située entre 5 et 50 mg (équivalent à 1/40 à 1/4 de cacahuète) avant l’ITO, passait à 10 cacahuètes (environ 2,38 g) à la fin de la période de maintenance qui comportait une augmentation des doses toutes les 2 semaines.
• L’étude d’Anagnostou et al. (12) se différencie des précédentes par l’importance des quantités d’arachide tolérées.
Vingt-deux enfants plus âgés que ceux des études précédentes (âge moyen : 11 ans) ont été sélectionnés par un TPO à l’arachide positif (dose réactogène de 1 à 110 mg). Le protocole consistait à atteindre 800 mg de protéine d’arachide/jour (5 cacahuètes/jour) en 8 à 38 semaines (avec 2 prises hebdomadaires), cette période d’escalade étant suivie d’une phase de maintenance de 30 semaines. Dix-neuf enfants sur 22 (85,5 %) ont atteint les 800 mg prévus. Un sur 22 (4,5 %) est sorti du protocole et 2 sur 22 (9 %) n’ont atteint que 200 à 400 mg. Si 86 % des enfants ont présenté des réactions secondaires, celles-ci n’ont jamais nécessité d’injection IM d’adrénaline. Un seuil d’IgEs contre l’arachide de 27,3 kUA/l a été défini, au-dessous duquel il n’a pas été nécessaire d’ajuster le protocole des patients. Inversement, lorsque les IgEs étaient supérieures à cette valeur, les doses d’arachide ont dû être diminuées. Globalement, la dose d’arachide tolérée a progressivement augmenté : 12/22 (54 %) toléraient sans aucune réaction 2,6 grammes au bout de 6 semaines, et il en était de même pour 14/22 (64 %) qui toléraient 6,6 g au bout de 30 semaines. En moyenne la dose tolérée a augmenté de 1 000 fois après l’ITO, mais les valeurs extrêmes (de 6 mg à 6 459 mg) traduisent de grandes disparités individuelles. Toutefois, la plupart des patients ont toléré 5 cacahuètes ce qui, là encore, les met à l’abri d’une ingestion accidentelle (12).
Au total, les caractéristiques des études sont très variables (7-15) :
1. protocoles le plus souvent ouverts ;
2. absence de groupes témoins de patients évitant uniquement l’arachide ;
3. présentation variable de l’arachide (farine, cacahuètes, biscuits contenant une quantité fixe d’arachide, allergènes commerciaux par voie sublinguale, etc.) ;
4. progression variable des doses ;
5. caractéristiques variables des patients (âge, symptômes) ;
6. indications sélectionnées ou non (tous les cas y compris les anaphylaxies ou uniquement les formes légères à modérées).
De façon générale, l’ITO entraîne des modifications immunologiques (baisse des IgEs, augmentation des IgG4s, actions cellulaires en particulier sur les cellules T régulatrices) témoignant de modifications nettes du statut immunitaire des patients.
Les risques d’effets secondaires pendant la phase de maintenance à domicile sont considérés comme faibles, mais ils peuvent être augmentés par certains facteurs comme l’effort physique, la prise de médicaments anti-inflammatoires, une infection intercurrente, le stress. Les écueils à éviter sont une mauvaise adhésion au traitement, génératrice d’accidents si les doses sont oubliées ou espacées.
Après l’acquisition d’une tolérance, la consommation d’arachide pour maintenir l’accoutumance n’est pas bien précisée.
• la mise à l’abri d’une ingestion d’arachide accidentelle ;
• la diminution du stress des patients et de leur entourage ;
• l’amélioration de la qualité de vie (7-15).
Toutefois, l’AAAAI (American Academy of Allergy Asthma and Immunology) recommande :
1. des études sur une large échelle, randomisées, contrôlées versus placebo et/ou versus éviction seule ;
2. Une évaluation des meilleures indications ;
3. Des protocoles standardisés ;
4. Une estimation des risques en particulier à domicile ;
Les protocoles actuels sont du domaine de la recherche clinique.
- Allergie aux protéines du lait de vache

L’induction de tolérance orale au lait de vache permet une guérison complète dans 36 à 88,9 % des cas (16). Le taux d’acquisition d’une tolérance permanente est inconnu (16). Toutefois, l’expérience clinique et les données de la littérature montrent que l’allergie aux protéines du lait de vache (APLV) guérit spontanément dans 80 à 90 % des cas avant l’âge de 10 ans.
• Parmi 68 cas d’APLV, Noormahomed et al. (17) ont colligé 20 cas (29 %) d’allergies persistantes après 2 ans malgré 1 ou 2 tests de réintroduction, ce qui constitue un pourcentage élevé de formes réfractaires5.
Plusieurs protocoles d’ITO ont été proposés :
– ITO accélérée en 3 jours (18,19) ;
– ITO progressive en 6 mois (20).
L’acquisition de la tolérance orale peut aller jusqu’à 95 % (21).
• Sánchez-Garcia et al. (22) ont utilisé un protocole en deux phases :
1. Induction de l’ITO pendant une semaine à l’hôpital sous cétirizine jusqu’à atteindre 200 ml de lait de vache ;
2. Maintenance à domicile avec prise quotidienne de 200 ml avec éviction des fromages eu égard au risque d’apparition d’allergie au lait de chèvre et de brebis (23).
Cent cinq patients ont été soumis à une ITO avec 81,9 % de réussite. Les concentrations d’IgEs dirigées contre le lait entier et la caséine étaient initialement plus basses dans le groupe ayant acquis la tolérance au lait de vache (23). Ainsi, avoir des IgEs basses est un marqueur de chances d’acquérir plus facilement la tolérance orale. Les auteurs soulignent la bonne tolérance de l’ITO au domicile.
• L’étude de Barbi et al. (24), portant sur 132 patients ayant reçu une ITO à domicile (2 à 84 mois), enregistre une réaction secondaire pour 100 doses ingérées. Ces réactions furent contrôlées de façon acceptable par des nébulisations d’adrénaline (221 réactions) et par des injections IM d’adrénaline (6 fois). Des concentrations d’IgEs contre le lait supérieures à 100 kUA/l étaient associées à une plus grande fréquence de réactions secondaires.
Au total
Comme pour l’arachide, les études sur l’ITO au lait de vache sont très disparates, en particulier les protocoles, les critères de sélection, l’âge des patients (etc.). Il faut rappeler qu’elles ne concernent, a priori, qu’un petit nombre patients puisque 70-80 % des nourrissons atteints d’APLV guérissent après éviction du lait de vache, remplacement par une formule de substitution (hydrolysat de protéines poussé) et réintroduction du lait après 6 mois d’éviction et de substitution6.
- Allergie à l’œuf

L’induction de tolérance par voie orale est utilisée depuis quelques années chez les patients ayant une AA persistante à l’œuf de poule (25-28).
Il existe plusieurs types de réponse (27, 29) :
1. Les enfants qui guérissent (36 %) ;
2.ceux qui répondent favorablement mais avec nécessité de consommer régulièrement de l’œuf (12 %) ;
3. Ceux dont la réponse est partielle (16 %) qui ne tolèrent pas de grandes quantités d’œuf ;
4. Les non-répondeurs qui réagissent à de faibles quantités d’allergène d’œuf (36 %).
• de Boissieu (27) a analysé 6 protocoles de réintroduction de l’œuf. Les âges sont très variés (6 mois à 55 ans) ainsi que la présentation des aliments, la technique de l’essai (2 randomisés et 4 ouverts), la dernière dose (300 mg de poudre d’œuf lyophilisé à 1 œuf dur). La dose d’entretien est très variable, et la durée des protocoles va de 4 à 24 mois7.
L’élargissement du régime avec consommation de biscuits très cuits est une première étape pour acquérir la tolérance (27).
• Hoppé et al. (28) ont effectué une induction de tolérance à l’œuf chez 11 enfants, 5 garçons et 6 filles, âgés en moyenne de 9,2 ans, selon une progression individuelle d’après la détermination du seuil réactogène au cours d’un TPO. Par sécurité, la première dose donnée au domicile était le 1/10e de celle qui avait été atteinte au cours du TPO. L’œuf était contenu dans des boudoirs faits à la maison, puis dans des portions de gâteaux jusqu’à un gâteau entier. Sept enfants sur 11 (64 %) ont pu consommer de l’œuf sans limitation, au bout de 3 à 4 mois, 2 ont toléré un demi-œuf, et 2 autres ont abandonné le protocole (refus ou vomissement des premières doses) (28).
Quelques protocoles hospitaliers d’ITO ont été également été rapportés chez des enfants, à l’exclusion des formes sévères avec anaphylaxie (31-34).
Les protocoles comportent 3 phases :
1. Induction accélérée (rush) ;
2. Escalade thérapeutique ;
3. Maintenance à domicile.
Un TPO est effectué à l’entrée dans le protocole, parfois pendant, puis à la fin de celui-ci, permettant de comparer l’évolution des doses réactogènes.
• Dans l’étude de Buchanan et al. (31,32), la dose réactogène augmente à l’issue de l’ITO mettant en principe les 7 patients à l’abri d’une ingestion accidentelle d’allergène.
• Dans l’étude de Itoh et al. (33) les 6 enfants (7-12 ans) qui réagissaient à une dose moyenne de 0,152 g (0,012 à 0,360 g) ont pu tolérer un œuf entier (60 grammes) en 12 jours (9 à 18 jours).
• Garcia-Rodriguez et al. (343) ont publié une étude portant sur 23 patients âgés de 5 à 17 ans. Vingt (86,9 %) ont terminé le protocole dont l’objectif était d’arriver à tolérer un œuf cuit en moins de 5 jours, après une phase d’induction rush.
Au total
Les résultats de ces études ne permettent pas de conclure sur les avantages de l’ITO accélérée par rapport à l’induction progressive de la tolérance orale. Les caractéristiques cliniques des patients sont différentes ; les séries publiées comportent des effectifs limités ; la présentation des allergènes est variable.
La tolérance au domicile est très bonne. Les effets sur la qualité de vie sont bénéfiques.
- Allergie à la noisette

Enrique et al. (3,4) ont publié une étude contrôlée d’ITS-SL à la noisette. Dans la première étude, les patients ne toléraient que 2,29 g de noisette au cours du TPO à l’entrée dans l’essai, contre 11,56 g de noisette au cours du second TPO après 8 à 12 semaines de traitement, soit 5 fois plus, progression permettant de les protéger contre une ingestion accidentelle.
- Autres allergies alimentaires
Allergie au blé
• Fujiono et Kurihara (35) ont effectué une ITO au blé chez 2 enfants de 6 ans (garçon) et 8 ans (fille) pour arriver à tolérer 5,6 g de farine de blé. Cette tolérance fut obtenue en 8 et 10 jours, au prix de réactions secondaires (6 chez le garçon et 9 chez la fille) nécessitant la prise d’antihistaminiques et de salbutamol. Par la suite, ces enfants ont consommé du blé 2 fois par semaine, avec persistance de la tolérance pendant 3 et 6 mois (35).
• Nucera et al. (36) ont réintroduit le blé sous forme de pâtes de blé dur, mieux tolérées que la farine, et plus faciles à évaluer (un spaghetti, deux, trois, etc.).
Allergie au poisson
Dans l’étude de Patriarca et al. (37), la tolérance au poisson a été obtenue dans 8 cas sur 11 (73 %) au bout de 5 mois en utilisant de la morue bouillie et en partant d’une dose de 0,00003 mg !
Allergie aux fruits et légumes

La littérature comporte plusieurs inductions de tolérance alimentaire à divers fruits et légumes de consommation courante.
• Des auteurs italiens ont rapporté des cas d’induction de tolérance à la tomate(38) et à la pomme (39). Au bout de 6 jours, un sujet tolérait 150 g de tomate. Pour la pomme, 2 sujets toléraient 200 g d’un mélange eau + pomme (apple mix shake).
Bouvier et al. (40) ont rapporté 18 cas d’induction de tolérance à la pomme chez des patients (18 à 51 ans) atteints d’un syndrome d’allergie orale (SAO). Cinq avaient une rhinite persistante sévère et 11 un asthme saisonnier intermittent léger. Après réintroduction à dose croissante, les 18 patients ont pu tolérer 2 grammes de pomme crue (40). Leur suivi est en cours.
La même équipe a réussi une induction de tolérance à la pomme chez une patiente de 46 ans présentant une allergie sévère aux rosacées (pêche, pomme, poire) s’étant manifestée par plusieurs épisodes d’anaphylaxie (41). La patiente a pu tolérer 8 grammes de pomme crue épluchée par jour, mais son suivi est en cours avec tentatives d’augmentation des doses d’entretien (41).
En 2012, au cours du syndrome d’allergie orale (SAO) à la pomme chez les patients ayant un syndrome d’allergie croisée bouleau-pomme, les 27 patients qui consommaient quotidiennement des quantités croissantes de pomme jusqu’à atteindre 128 grammes ont guéri de leur allergie orale. Par contre, les symptômes ont persisté chez les 13 patients du groupe témoin (p = 0,0001) (42).
L’ITS au pollen de bouleau aussi bien par voie sous-cutanée (ITS-SC) que sublinguale (ITS-SL) semble également efficace ; elle serait capable d’induire une tolérance orale à la pomme dans 14,2 % (ITS-SL) à 25 % (ITS-SC) des cas (43). Dans 28,6 % (ITS-SL) à 37,5 % (ITS-SC) des cas, l’immunothérapie augmente le seuil de tolérance à la pomme (43).
• L’induction de tolérance a été utilisée avec succès chez une jeune femme de 29 ans atteinte d’AA au kiwi avec anaphylaxie récidivante (44). Les IgEs étaient à 28 kUA/l réagissant contre l’allergène majeur du kiwi, une protéine de 30 kDa (Act c 1). La gravité des symptômes et l’impossibilité d’une éviction stricte ont motivé une induction de tolérance orale, menée progressivement depuis une dose de 0,1 ml à la dilution de 10-4, à raison de 3 doses par jour, jusqu’à atteindre 1 ml de l’extrait non dilué (44). Au cours de cette ITO, la papule des PT a diminuée et des IgG4s contre le kiwi sont apparues (44). L’homogénéisation et le chauffage du kiwi semblent diminuer l’allergénicité du kiwi (45)…

Omalizumab au cours des allergies alimentaires sévères
Un cas d’AA sévère au lait de vache avec échec d’une induction de tolérance par voie sublinguale a été traité par omalizumab (46).
Cette APLV avait débuté au cours des premiers mois de vie, le bilan allergologique à 4 mois montrant un PT au lait cru à 3,5 mm, et des IgEs à 77,5 UA/l. Sous éviction des protéines du lait de vache, le TPO au lait bouilli était positif à 20 ml (à 1 an) puis 5 ml (à 18 mois). Entre 3 et 9 ans il développa 4 épisodes d’anaphylaxie après l’ingestion d’aliments contaminés par le lait de vache. Une ITS-SL au lait de vache fut commencée, mais arrêtée deux fois en raison de crises sévères d’asthme, puis reprise aux doses de 1 puis 6 gouttes de lait (46).
A l’âge de 10 ans, la récidive des anaphylaxies et le risque d’asthme fatal ont fait entreprendre une ITS-SL sous omalizumab. Après 5 mois de traitement le TPO au lait de vache était négatif pour 320 ml ce qui permettait de continuer l’ITS au lait sous omalizumab. Actuellement l’enfant consomme 8 ml de lait par jour sans risque d’anaphylaxie par ingestion d’aliments contaminés par les protéines du lait de vache (49).
Conclusion
Il est donc possible d’induire une tolérance alimentaire chez les patients atteints d’allergie aux aliments. Déjà nombreuses, les études publiées sont très disparates : les aliments sont très divers, l’histoire naturelle de chaque AA est différente, les recrutements sont variables ainsi que la sélection des patients, etc.
Toutefois, l’induction d’une tolérance est possible, le plus souvent très satisfaisante, pour le lait de vache et l’œuf de poule.
Elle est plus difficile à obtenir, souvent partielle, pour l’arachide, mais les études disponibles suggèrent que l’augmentation des doses réactogènes est suffisante pour éviter des accidents par ingestion accidentelle d’allergènes.
Néanmoins, des études conduites avec les principes de la médecine fondée sur les preuves sont indispensables pour préciser les indications de l’induction de tolérance orale en fonction de l’âge, des symptômes cliniques, et surtout des aliments impliqués.
A RETENIR
Comment induire une tolérance alimentaire en pratique ?
La tolérance peut être obtenue :
• soit de façon progressive (accoutumance par voie orale) ;
• soit de façon plus rapide (immunothérapie) en utilisant une phase d’induction accélérée (rush), puis une phase de maintenance dans le cadre d’une immunothérapie par voie orale (ITO).
La distinction entre ces deux techniques est théorique et pratique :
• la première, surtout utilisée pour le lait de vache et l’œuf de poule, est rapidement effectuée à domicile ;
• la seconde est du ressort d’équipes rompues à la prise en charge des AA dans un cadre hospitalier (induction et escalade des doses) et sous la supervision de praticiens rompus à la prise en charge spécialisée des AA.
1 Au milieu du XXe siècle des tentatives anecdotiques ont été réalisées avec le poisson, l’œuf de poule et le lait de vache.
2 Certains pédiatres allergologues se souviendront de l’étude de Mouterde et al. (5) qui, en 1988, ont rapporté une expérience de réintroduction-accoutumance sous cromoglycate disodique par voie orale au cours des formes réfractaires d’allergie aux protéines du lait de vache : l’objectif était de rechercher une induction de tolérance.
3 Les protocoles sont variables (caractéristiques des patients, présentation de l’allergène, doses utilisées). La phase d’induction (rush) varie de quelques heures à quelques mois. Pendant la phase d’entretien, l’allergène est consommé de façon quotidienne.
4 Ce sont les patients qui auraient le plus besoin d’une induction de tolérance, mais qui sont le plus souvent exclus des protocoles en raison des risques encourus…
5 Les disparités d’évaluation de la fréquence des formes réfractaires d’APLV, moins de 5 % pour certains, près de 30 % pour d’autres (17) peuvent s’expliquer par des biais de recrutement : pourcentage faible d’APLV réfractaires en pédiatrie générale, pourcentage beaucoup plus élevé en allergologie pédiatrique.
6 Au vu du nombre d’enfants placés sous ITO au lait de vache, on peut se demander si certains patients sont atteints d’APLV réellement persistantes (absence de guérison après au moins deux tentatives de réintroduction infructueuses) ou à des formes qui auraient guéri spontanément.
7 Comme pour le lait de vache. Les indications sont à préciser car certains enfants acquièrent spontanément la tolérance.
