Pro ou anti-gluten ? Le débat sur cette protéine contenue dans la plupart des céréales de consommation courante est lancé autant dans la littérature scientifique que grand public. En 3 ans, le volume de recherches Google et de références sur le sujet a été multiplié par 3.
Au départ, un spectre des pathologies associées au gluten qui s’élargit et qui est encore incomplètement connu (Fig. 1).

Figure 1 – Classification des pathologies associées au gluten.
Le gluten, c’est quoi ?
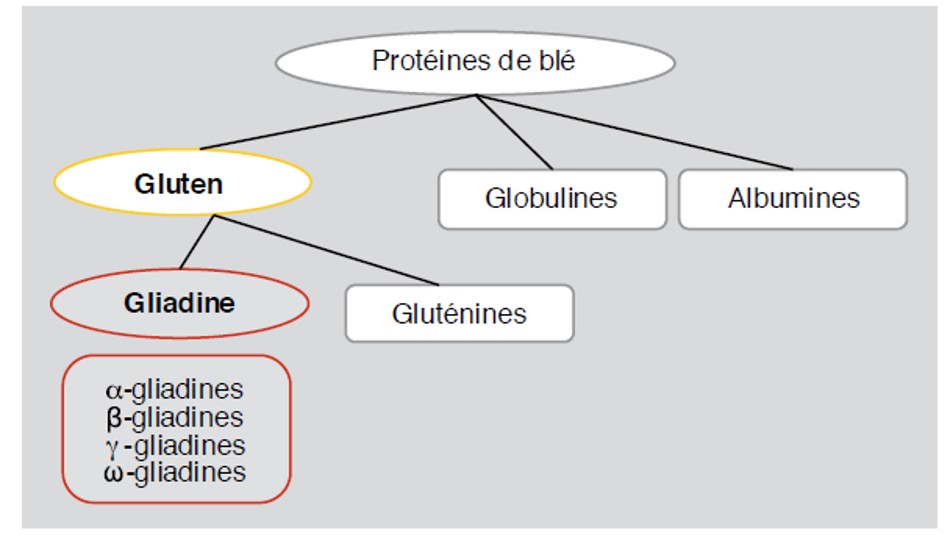
On trouve du gluten dans 3 principales céréales : le blé, l’orge et le seigle. Un grain de blé se compose majoritairement d’amidon (65 à 70 %), d’eau (12-13 %), de minéraux, d’une faible proportion en sucres simples et de 10 à 12 % de protéines. On trouve 2 classes de protéines dans le groupe gluten : les gliadines et les gluténines. Les gluténines sont recherchées, car elles confèrent de l’élasticité et de la viscosité à différents produits alimentaires, mais les fragments peptidiques immunologiques qui déclenchent des symptômes dans la maladie coeliaque sont dans le groupe gliadines(Fig. 2).
Dans cette pathologie, la gliadine du gluten passe la barrière intestinale et se lie à la transglutaminase avec laquelle elle forme un complexe qui sera reconnu par les HLADQ2 et/ou HLA-DQ8. Une réponse cellulaire T anormale dirigée contre ces fragments est ensuite à l’origine de la maladie.
Figure 2 – Protéines du blé.
Les pathologies auto-immunes associées au gluten
En premier lieu, la maladie coeliaque (MC), maladie auto-immune est induite par la consommation de gluten chez des individus génétiquement prédisposés [1, 2]. La prévalence de la MC est d’environ 1 % dans la plupart des pays du monde.
Les patients à risque portent les allèles codants pour les HLA-DQ2 ou HLA-DQ8, 25 à 35 % de la population générale étant porteuse de ces types HLA. En dehors de la susceptibilité génétique, plusieurs études récentes ont montré que l’âge d’introduction du gluten ou l’allaitement maternel n’avaient pas d’impact sur le risque de développer une MC. Le seul traitement est un régime d’exclusion du gluten strict et prolongé toute la vie. Historiquement, le diagnostic était généralement fait devant un tableau clinique pédiatrique associant diarrhée chronique, douleurs abdominales, fatigue, signes de malabsorption, des formes plus frustes peu ou non symptomatiques notamment chez l’adulte sont maintenant caractérisées.
Le spectre de symptômes cliniques est actuellement beaucoup plus large que les manifestations gastrointestinales typiques
(Tab. 1), ce d’autant que le dépistage par la réalisation de sérologie est simple.
Comme pour d’autres pathologies auto-immunes ou dysimmunitaires, le nombre de diagnostics semble augmenter, en partie du fait d’une meilleure connaissance de la variabilité de présentation clinique des malades. Associées à la MC, l’ataxie liée au gluten est responsable d’une neuropathie périphérique avec atteinte cérébelleuse et la dermatite herpétiforme de lésions papulo-vésiculeuses. Dans ce premier groupe de pathologies liées au gluten, l’éviction de la protéine permet une régression des symptômes.
Les allergies au blé
L’allergie au blé est habituellement de type IgE médiée. Elle se manifeste, après ingestion de blé, par une dermatite atopique, une urticaire de contact ou des symptômes respiratoires ou gastrointestinaux.
Le diagnostic se fait sur l’histoire clinique, des prick-tests et IgE spécifiques positifs. Quatre études avec épreuves d’éviction/réintroduction chez des enfants de 3 à 14 ans ont conclu à une prévalence moyenne de l’allergie au blé à 0,25 % [1].
L’allergie au blé est plus fréquente chez le jeune enfant et d’évolution le plus souvent favorable après l’âge de 3-5 ans, ce qui concorde avec des taux d’allergie au blé chez l’adulte qui seraient très faibles. De plus, la grande majorité des enfants ayant une allergie au blé ont une dermatite atopique associée ou d’autres allergies alimentaires, notamment à l’oeuf et au lait [3]. Une forme typique est l’asthme et la rhinite du boulanger qui sont une réponse immunologique IgE médiée chez des personnes travaillant avec de la farine de blé.
L’allergie au blé la mieux décrite est une forme induite par l’effort. Il s’agit d’une forme particulière d’allergie déclenchée par l’ingestion de blé suivie d’un effort physique. L’allergène majeur serait la ω-5-gliadine, mais une autre forme, secondaire à une sensibilisation par la peau ou par les muqueuses de protéines de blé présentes dans les savons, a également été décrite. L’allergie au blé induite par l’effort peut se manifester par une urticaire, un oedème de Quincke ou un choc anaphylactique. Là encore, la prévalence, mal connue semble être faible, évaluée dans une étude japonaise à moins de 0,02 % chez l’enfant [4]. À l’heure actuelle, la prise en charge de l’allergie au blé non liée à l’effort repose sur un régime d’éviction des aliments contenant du blé. En cas d’allergie au blé liée à l’effort, il est recommandé de ne pas faire d’exercice physique dans les 4 heures suivant la consommation de blé. La formation des patients/parents à l’utilisation des stylos d’auto-injection d’adrénaline peut également être indiquée.
L’hypersensibilité au gluten
À côté de ces pathologies connues depuis longtemps et pour lesquelles des tests diagnostiques objectifs existent, une entité appelée hypersensibilité au gluten (HSG) a été décrite [5, 6]. On parle d’HSG lorsque les patients décrivent des symptômes cliniques déclenchés par l’ingestion de gluten en l’absence d’éléments en faveur d’une MC (sérologies IgA antitransglutaminases et anti-endomysium négatives, biopsies intestinales normales) et en l’absence d’allergie au blé. Le statut HLA peut être variable ainsi que le taux d’IgA antigliadine. Les premières descriptions datent d’une trentaine d’années [7], mais le nombre de patients qui rapportent une intolérance au gluten semble en forte augmentation, cette entité étant de plus en plus traitée et considérée par les médias et l’industrie agroalimentaire. Aucune étude épidémiologique puissante n’est disponible sur ce sujet et ce d’autantque les critères diagnostiques sont encore flous et reposent souvent sur un auto-diagnostic, mais la prévalence de l’HSG serait entre 3 et 6 % de la population générale [8]. Dans une région de Nouvelle-Zélande, la prévalence chez l’enfant était de 5 % [9].
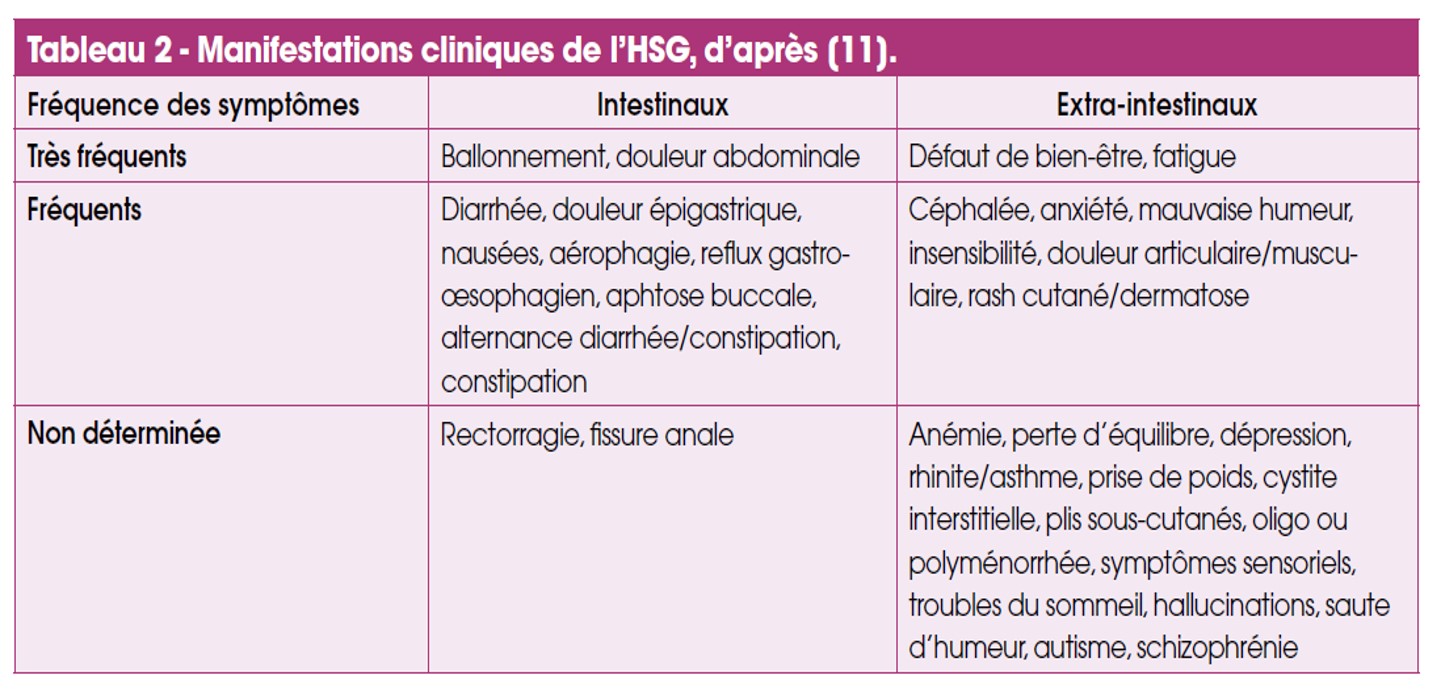
Les symptômes apparaissent dans les heures suivant l’ingestion du gluten. Les patients décrivent des signes gastrointestinaux de type troubles fonctionnels intestinaux (TFI)-like (douleur abdominale, ballonnement, diarrhée, constipation), mais aussi des signes extradigestifs comme des céphalées, des douleurs articulaires ou musculaires, de la fatigue, notamment chez l’enfant, ou des troubles de l’humeur (Tab. 2). Les signes de l’HSG disparaissent après éviction du gluten et réapparaissent dans les heures ou les jours qui suivent la réintroduction, de préférence en aveugle.
Récemment, plusieurs équipes se sont intéressées à la relation entre la consommation de gluten et des pathologies psychiatriques comme la schizophrénie ou les troubles du spectre autistique. Actuellement, les revues critiques de la littérature n’ont pas permis d’établir un lien ferme entre le gluten et ces pathologies [10]. De plus, la relation de cause à effet entre la consommation de gluten et les pathologies neuropsychiatriques est difficile à caractériser du fait du temps de latence entre ces événements. Afin d’éviter que l’HSG soit uniquement un diagnostic d’élimination, un groupe d’experts a défini en 2015 un protocole diagnostique pour standardiser les critères et guider le clinicien [11]. Ce protocole se compose de 2 parties :
- L’évaluation de la réponse clinique à l’éviction du gluten (régime sans gluten, RSG) durant 6 semaines ;
- L’effet de la réintroduction du gluten après une période de régime.
Chez les patients qui sont déjà au RSG, les auteurs préconisent de tenter une réintroduction d’emblée. Un patient répondeur au RSG est défini par une diminution d’au moins 30 % d’un de ses 3 principaux symptômes ou d’au moins 1 symptôme sans aggravation des autres par rapport à la baseline et pendant au moins 3 des 6 semaines de régime. L’intensité et la fréquence des symptômes sont à évaluer régulièrement avec des questionnaires patients dédiés. Ce type de protocole paraît utile afin de standardiser et de mieux définir les caractéristiques cliniques et biologiques des patients suspects d’HSG, il semble cependant difficile d’application tel quel en pratique courante.
Gluten or not gluten
La terminologie d’HSG ou Non Celiac Gluten Sensibility (NCGS) est toujours débattue, et sera peut-être remplacée dans un futur proche par l’hypersensibilité au blé ou Non Celiac Wheat Sensibility (NCWS). Il est en effet possible que les protéines déclenchant les troubles soient différentes du gluten, comme l’inhibiteur de la trypsine amylase (ATI) déjà impliquée dans l’asthme du boulanger. Dans ce cas, seul le blé serait à exclure alors que l’orge et le seigle, qui contiennent aussi du gluten, ne seraient pas en cause. D’autres nutriments pourraient favoriser des troubles digestifs. L’intolérance alimentaire dans les troubles fonctionnels intestinaux (TFI) est une hypothèse ancienne.
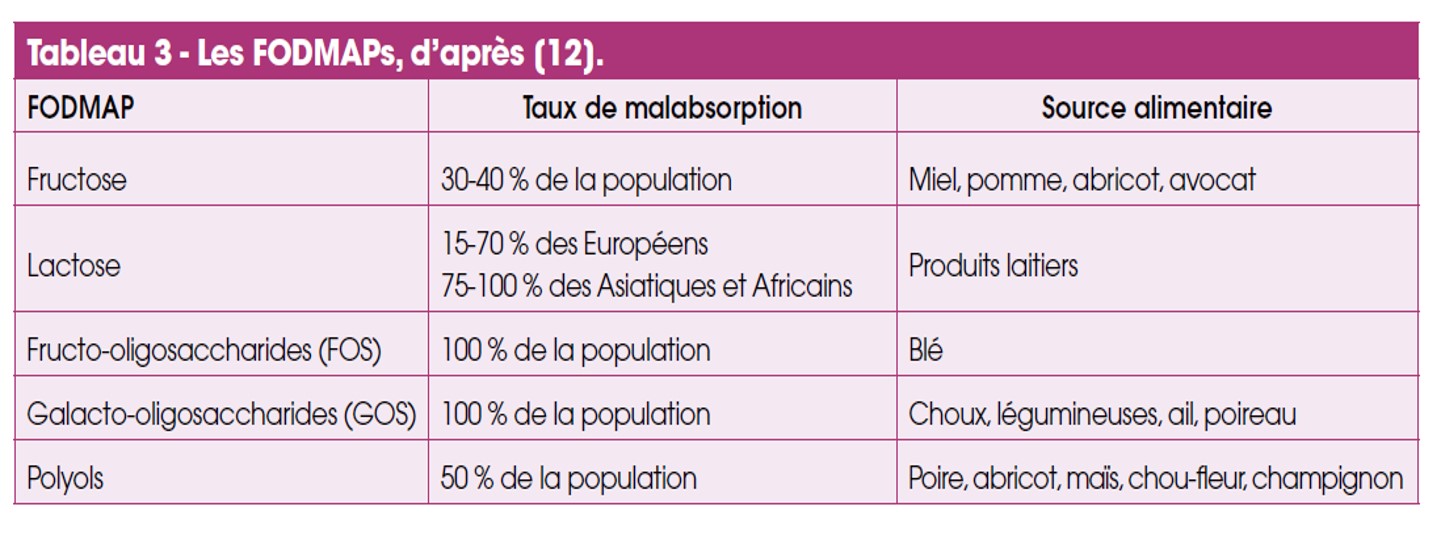
Il y a une dizaine d’années, un régime ayant pour objectif de réduire les sucres à chaînes courtes mal absorbés a été développé. On les appelle les FODMAPs pour Fermentable Oligo-di-, monosaccharides and Polyols (Tab. 3).
Un régime sans FODMAPs a pour objectif de réduire les sucres non digérés qui favorisent la prolifération bactérienne colique. L’hypothèse est qu’une diminution de la fermentation au niveau intestinal diminuerait les ballonnements intestinaux, les douleurs, les flatulences. Plusieurs études randomisées en double aveugle chez des patients adultes et une étude chez l’enfant ont montré une amélioration des symptômes de TFI chez 50 à 60 % des patients [12, 13] dans le groupe régime pauvre versus normal en FODMAPs.
Cependant, une étude suédoise récente a comparé un régime pauvre en FODMAPs à un régime standard basé sur des règles hygiénodiététiques simples recommandées par le National Institute for Care and Health Excellence sans mettre en évidence de différences [14]. Il existe 5 catégories de FODMAPs. Les régimes d’éviction proposés sont une première étape pour identifier la catégorie de FODMAPs qui pourrait engendrer des troubles digestifs chez une personne.
L’éviction de l’ensemble des 5 catégories sur une période prolongée, notamment chez l’enfant, n’est pas recommandée et pourrait avoir un impact négatif sur sa croissance et son développement. De plus, un suivi par une diététicienne paraît indispensable (Tab. 4).

Le régime sans gluten
Le spectre des pathologies associées au gluten s’élargit et se définit peu à peu. Au-delà des considérations médicales, il existe une mode du sans-gluten, associée à une augmentation importante des ventes de produits gluten-free poussées par des campagnes marketing [15]. L’offre du sans gluten se multiplie avec parfois ajout de multiples additifs, émulsifiants et épaississants dont les effets sur les TFI ne sont pas connus. De fait, on trouve du gluten partout, pas seulement dans des aliments à base de céréales, mais aussi dans de la charcuterie (rillettes, jambon), des plats préparés et même dans le chocolat ! Une équipe autrichienne s’est intéressée à la qualité nutritionnelle et au coût de 63 produits sans gluten commercialisés [16]. Ils ont inclus des aliments à base de farine, pain, pâtes, céréales, gâteaux, snacks, plats préparés. Au total, les produits sans gluten contenaient 2 fois moins de protéines et souvent moins de sel. Le prix de ces aliments était en moyenne entre 2 et 2,7 fois plus élevé que des produits similaires avec gluten. Ces constatations sont superposables à celles de 60 Millions de consommateurs [15]. Ainsi, il est indiscutable que pour les patients porteurs de MC ou d’allergie au blé, le RSG est bénéfique pour la santé. Concernant les personnes en bonne santé ou avec TFI sans éléments suffisants pour affirmer le diagnostic d’HSG, il ne semble pas qu’un régime sans gluten soit bénéfique.
Encore beaucoup de questions…
Le diagnostic d’HSG ou d’hypersensibilité au blé/FODMAPs est actuellement très difficile, car il repose sur des régimes d’exclusion/réintroduction proposés sur des signes d’appel non spécifiques et peu de signes objectifs. Les questions sont pour le moment plus nombreuses que les réponses. Quels sont les liens entre les différentes pathologies du gluten ? Comment s’intègre l’HSG dans les troubles fonctionnels intestinaux ? Quelles sont précisément les protéines impliquées ? L’HSG estelle transitoire ou permanente ? Y a-t-il un seuil de tolérance du gluten, du blé ou des FODMAPs pour chaque individu ? Quelle est la fréquence exacte de l’HSG chez l’enfant et l’adulte ? Quel est l’imact du gluten sur les troubles de l’humeur et par quels mécanismes agit-il ? Quand et à qui proposer un RSG ou un autre régime ? Combien de temps le proposer ? Les prochaines années et nouvelles recherches vont sans doute rapidement faire évoluer ces concepts et apporter quelques éléments de réponse.
Les auteurs déclarent ne pas avoir de liens d’intérêts concernant la rédaction de cet article.